Laborarbeit auf dem Schiff

Lebendzählung von Protisten - ein Interview mit Manon Hohlfeld
Manon Hohlfeld ist Doktorandin an der Uni Köln. Im Rahmen des MGF-Ostsee Projekts untersucht sie farblose Protisten - kleine Mikroorganismen, die nur aus einer einzigen Zelle bestehen und einen Zellkern besitzen. Dazu zählen z.B. Geißeltierchen, Amöben, Ciliaten (Wimpertierchen) oder Foraminiferen (Kammerlinge). Während der Expedition mit dem Forschungsschiff Elisabeth Mann Borgese (EMB238) hat Manon Protisten lebend gezählt. Wie das an Board funktioniert und ob das Schwanken des Schiffs beim Zählen stört, erzählt sie hier.
Interviewer: Manon, damit Du auf dem Schiff überhaupt auszählen konntest, mussten sehr viel Materialien und Gerätschaften mit an Bord genommen werden. Warum ist es dennoch besser Protisten bereits an Bord zu zählen und nicht erst im Labor an der Uni Köln?
Manon: Ja, man braucht schon Einiges für die Lebendzählungen. Wichtig sind vor allem ein Lichtmikroskop und Mikroskopier-Zubehör wie Objektträger und Pipetten, um die kleinen Organismen für das menschliche Auge sichtbar zu machen. Außerdem wird sogenanntes autoklaviertes d.h. sterilisiertes Seewasser benötigt, alternativ aber auch gefiltertes Seewasser. Da wir das Autoklavieren auch an Board machen, benötigten wir natürlich auch das hierfür nötige Material, wie einen Druckkochtopf. Zum Filtern nehmen wir einen Filter mit einer Porengröße von 0.2 µm - das ist ein Fünftel eines Tausendstel Millimeters!
Trotzdem kann man die Lebendzählungen eigentlich nur an Bord machen, denn die Zeit bis wir wieder in Köln sind, ist einfach zu lang - bis dahin haben die Lebendproben sich hinsichtlich ihrer Artzusammensetzung sehr verändert. Nach der Probennahme werden die Protisten aus den Proben kultiviert, d.h. es werden künstlich Bedingungen geschaffen, die ein Wachstum der Organismen gewährleisten. In Kultur setzen sich dann einige wenige Arten durch und dominieren, während andere Arten komplett verschwinden, da sie mit der Konkurrenz oder mit den Bedingungen in Kultur nicht gut zurechtkommen. Es gibt aber auch die Möglichkeit, die Proben mit Chemikalien zu fixieren und zu färben, dann kann man sie auch später auszählen, allerdings kann man dann nicht bestimmen, um welche Art es sich handelt. Durch die Fixierung verändern die Protisten ihre Form und verlieren oft auch die Geißeln - fadenförmige Anhänge auf der Oberfläche einzelner Zellen, die der Fortbewegung dienen. Das Problem dabei ist, dass ein Großteil der Protisten nur anhand ihrer Bewegungen bestimmt werden kann. Wir brauchen also die Lebendzählungen, um die Arten zuordnen zu können. Daher verwenden wir immer beide Methoden, Lebendzählungen und fixierte Zählungen, da beide Methoden die zuvor beschriebenen Vor- und Nachteile haben.

Interviewer: Wie läuft eine Probennahme ab, um überhaupt an Protisten zu kommen?
Manon: Wir haben Proben mit dem Multicorer genommen, ein Gerät das Sedimentkerne und Bodenwasser vom Meeresgrund holt, und haben die Kerne in verschiedene Schichten geschnitten. Von den Sedimentproben wird dann ein definiertes Volumen (einen kleinen Messlöffel voll Sediment) genommen und mit filtriertem oder autoklaviertem Seewasser verdünnt. Die so aufbereiteten Proben schaue ich mir dann unter dem Lichtmikroskop an (mehrere Tropfen zwischen 1 und 5 µl) und zähle die vorkommenden Protisten darin. Das sind vor allem Geißeltierchen, Amöben und Wimpertierchen. Das Ganze ist allerdings nichts für jemanden, der schnell seekrank wird. Die Probe unter dem Mikroskop bewegt sich mit jeder Welle. Aber auf der EMB238 Fahrt hatten wir wirklich Glück mit dem Wetter und man hat kaum gemerkt, dass man überhaupt auf einem Schiff ist.
Interviewer: Gibt es schon erste (überraschende) Erkenntnisse, die Du bereits an Board gemacht hast?
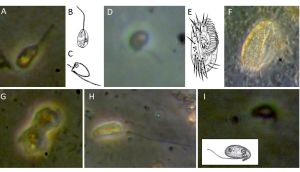
Manon: Die Lebendzählungen auf der EMB238 Fahrt waren schon etwas überraschend für mich, da ich bis zu dieser Fahrt hauptsächlich Proben aus der Tiefsee, vor allem aus dem Atlantik, untersucht habe. Die Ostsee hat mit nur 2-20‰ einen sehr viel geringeren Salzgehalt als beispielsweise der Atlantik mit 35‰, daher haben wir auf der EMB238 Fahrt unter anderem auch Arten gefunden, die normalerweise hauptsächlich im Süßwasser zu finden sind. Ich habe aber auch typische marine, benthische Protisten gefunden, insbesondere Amöben (siehe Bild G), Ancyromonaden (Bild C und D), Eugleniden (Bild A, B) und Bodoniden (Bild H und I), sowie Ciliaten (Bild E und F), die man zum Beispiel in der Tiefsee nur extrem selten findet.
Interviewer: Was sind die nächsten Schritte bei der Auswertung?
Manon: An Bord habe ich schon die Lebendzählungen gemacht und Proben fixiert und angefärbt. Zum Färben verwenden wir DAPI - das ist ein Fluoreszenzfarbstoff, der in der Fluoreszenzmikroskopie zur Markierung von DNA eingesetzt wird. Außerdem habe ich Proben für molekulargenetische Untersuchungen eingefroren und lebende Kulturen angesetzt. Zurück in Köln haben wir uns vor allem mit der weiteren Kultivierung beschäftigt, da dies zügig passieren musste. Dabei vereinzeln wir Arten, damit sie langfristig in Kulturen überleben und wir sie morphologisch und phylogenetisch charakterisieren und bestimmen können. Als nächstes werden wir dann an den tiefgefrorenen Proben eine Metabarcoding-Sequenzierung vornehmen. Das bedeutet, wir sequenzieren bei allen Organsimen in der Probe eine bestimme sogenannte Marker-Region auf einer bestimmten Genregion, um so einen Überblick über die ganze Protisten-Gemeinschaft zu bekommen. Wir vergleichen dann die Gemeinschaft im marinen Schutzgebiet Fehmarnbelt mit der Gemeinschaft in der Kontrollregion, wo viel bodenberührende Fischerei stattfindet.
Interviewer: Vielen Dank für das informative Interview!

